KHTN 8 Bài 11: Muối - Hướng dẫn giải chi tiết sách Kết nối tri thức trang 48, 49, 50, 51, 52
Giải Khoa học tự nhiên 8 Bài 11: Muối là tài liệu hữu ích dành cho học sinh lớp 8, giúp các em dễ dàng giải đáp các câu hỏi thảo luận và bài tập từ trang 48 đến trang 52 trong sách Kết nối tri thức với cuộc sống.
Bên cạnh đó, tài liệu này cũng là nguồn tham khảo quý giá cho giáo viên trong việc soạn giáo án Bài 11 thuộc Chương II: Một số hợp chất thông dụng trong sách Khoa học tự nhiên 8. Cả thầy cô và học sinh đều có thể khám phá chi tiết nội dung bài viết dưới đây từ EduTOPS.
Khái niệm
Câu 1: Viết công thức hóa học của các muối sau: potassium sulfate, sodium hydrogensulfate, sodium hydrogencarbonate, sodium chloride, sodium nitrate, calcium hydrogenphosphate, magnesium sulfate, copper(II) sulfate.
Trả lời:
- Potassium sulfate: K2SO4;
- Sodium hydrogensulfate: NaHSO4;
- Sodium hydrogencarbonate: NaHCO3;
- Sodium chloride: NaCl;
- Sodium nitrate: NaNO3;
- Calcium hydrogenphosphate: CaHPO4;
- Magnesium sulfate: MgSO4;
- Copper(II) sulfate: CuSO4
Câu 2: Gọi tên các muối sau: AlCl3; KCl; Al2(SO4)3; MgSO4; NH4NO3; NaHCO3.
Trả lời:
- AlCl3: aluminium chloride;
- KCl: potassium chloride;
- Al2(SO4)3: aluminium sulfate;
- MgSO4: magnesium sulfate;
- NH4NO3: ammonium nitrate;
- NaHCO3: sodium hydrogencarbonate.
Câu 3: Viết phương trình hóa học của phản ứng tạo thành muối KCl và MgSO4.
Trả lời:
- Một số phương trình hóa học của phản ứng tạo thành muối KCl:
2K + 2HCl → 2KCl + H2
KOH + HCl → KCl + H2O
K2O + 2HCl → 2KCl + H2O
K2CO3 + 2HCl → 2KCl + CO2 + H2O.
- Một số phương trình hóa học của phản ứng tạo thành muối MgSO4:
Mg + H2SO4 → MgSO4 + H2
Mg(OH)2 + H2SO4 → MgSO4 + 2H2O
MgO + H2SO4 → MgSO4 + H2O
MgCO3 + H2SO4 → MgSO4 + CO2 + H2O
Tính chất hóa học
Trong dung dịch, giữa các cặp chất nào sau đây có xảy ra phản ứng? Viết phương trình hóa học của các phản ứng đó.
| Na2CO3 | KCl | Na2SO4 | NaNO3 | |
| Ca(NO3)2 | ? | ? | ? | ? |
| BaCl2 | ? | ? | ? | ? |
| HNO3 | ? | ? | ? | ? |
Trả lời:
| Na2CO3 | KCl | Na2SO4 | NaNO3 | |
| Ca(NO3)2 | × | - | × | - |
| BaCl2 | × | - | × | - |
| HNO3 | × | - | - | - |
(“×”: xảy ra phản ứng; “-”: không xảy ra phản ứng)
Phương trình hóa học:
Ca(NO3)2 + Na2CO3 → CaCO3 + 2NaNO3
Ca(NO3)2 + Na2SO4 → CaSO4 + 2NaNO3
BaCl2 + Na2CO3 → BaCO3 + 2NaCl
BaCl2 + Na2SO4 → BaSO4 + 2NaCl
2HNO3 + Na2CO3 → 2NaNO3 + CO2 + H2O
Mối quan hệ giữa các hợp chất vô cơ
Tính chất hóa học của các hợp chất vô cơ được tóm tắt bằng sơ đồ dưới đây:
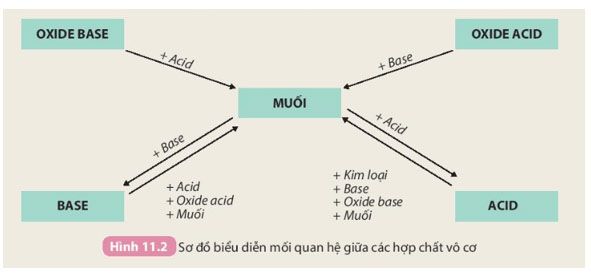
Dựa vào sơ đồ Hình 11.2, hãy nêu tính chất của oxide, acid, base và viết phương trình hóa học minh họa.
Trả lời:
- Tính chất của oxide:
+ Oxide base phản ứng với acid tạo thành muối và nước. Ví dụ:
CaO + 2HCl → CaCl2 + H2O.
+ Oxide acid phản ứng với dung dịch base tạo thành muối và nước. Ví dụ:
SO2 + 2NaOH → Na2SO3 + H2O.
- Tính chất của acid:
+ Phản ứng với kim loại tạo thành muối và khí. Ví dụ:
Fe + 2HCl → FeCl2 + H2.
+ Phản ứng với base tạo thành muối và nước. Ví dụ:
HCl + NaOH → NaCl + H2O.
+ Phản ứng với oxide base tạo thành muối và nước. Ví dụ:
H2SO4 + Na2O → Na2SO4 + H2O.
+ Phản ứng với muối tạo thành muối mới và acid mới. Ví dụ:
H2SO4 + BaCl2 → BaSO4 + 2HCl.
- Tính chất của base:
+ Phản ứng với acid tạo thành muối và nước. Ví dụ:
Ca(OH)2 + H2SO4 → CaSO4 + 2H2O
+ Phản ứng với oxide acid tạo thành muối và nước. Ví dụ:
Ca(OH)2 + CO2 → CaCO3 + H2O.
+ Phản ứng với dung dịch muối tạo thành muối mới và base mới. Ví dụ:
Ca(OH)2 + Na2CO3 → CaCO3 + 2NaOH.
- Luyện Từ và Câu: Chủ Ngữ - Bài 9 Sách Tiếng Việt Lớp 4 Tập 1 Bộ Cánh Diều

- Viết bài văn nghị luận về một vấn đề xã hội (trình bày quan điểm đồng tình) - Dàn ý chi tiết và 18 bài văn mẫu lớp 7

- Phân tích nhân vật Vũ Nương trong tác phẩm Chuyện người con gái Nam Xương (Sơ đồ tư duy) - 4 Dàn ý & 23 bài văn mẫu lớp 9 xuất sắc nhất

- Nghị luận về Bạo lực học đường hiện nay (Sơ đồ tư duy) - 6 Dàn ý & 38 bài văn mẫu lớp 9 xuất sắc nhất

- Văn mẫu lớp 4: Bài văn tả cây tràm - Miêu tả cây cối đạt điểm cao

